Tác giả: Tiến sĩ Tongwen Wang
Nhà nghiên cứu chính về ung thư và các bệnh kháng thuốc
Khoa Miễn dịch học
Trung tâm Nghiên cứu Virginia Mason
Đại học Washington
[ChanhKien.org] Vào một ngày đầu xuân, khi đang trên đường đi làm, có một người lạ bắt chuyện với tôi và hỏi thăm về nghề nghiệp của tôi. Sau khi biết rằng tôi là một nhà nghiên cứu về ung thư, mắt ông sáng lên và hỏi: “Có phải anh đang tìm phương thuốc chữa bệnh ung thư không?” Câu hỏi của ông ấy in sâu vào tâm trí tôi và bây giờ tôi muốn chia sẻ một số suy nghĩ với các bạn.
Kể từ khi bà tôi qua đời đột ngột vì căn bệnh ung thư gan ác tính khoảng 20 năm trước đây, từ “ung thư” chưa bao giờ rời khỏi tâm trí và trái tim của tôi. Từ trái tim non nớt của mình tôi có một niềm hy vọng vô tư rằng một ngày nào đó tôi sẽ tìm ra cách chữa bệnh ung thư, và điều đó đã đưa tôi đến tận giai đoạn này trong sự nghiệp của mình. Từ năm 1988 đến nay, tôi đi theo con đường của khoa học hiện đại dựa trên giản hóa luận để nghiên cứu sinh học ở nhiều cấp độ: từ giải phẫu học đến mô học, sinh học tế bào, và cuối cùng đến sinh học phân tử, sử dụng nấm men làm hệ thống mô hình để nghiên cứu biến đổi gen. Sau khi lấy bằng tiến sĩ, tôi cảm thấy mình đã sẵn sàng để mặt-đối-mặt với bệnh ung thư, do đó tôi đã bước vào lĩnh vực nghiên cứu ung thư. Cũng giống như nhiều người khác, tôi làm nghiên cứu trong lĩnh vực này thông qua quan sát các tế bào trong những hệ thống nhân tạo, đặc biệt những gì chúng ta gọi là hệ thống trong ống nghiệm, mà trong đó các dòng tế bào lớn lên trong các đĩa petri.
Tiến sĩ Tongwen Wang (Nguồn: people.ku.edu)
Năm 1992, khi tôi bắt đầu khóa huấn luyện sau tiến sĩ tại bệnh viện Massachusetts ở Boston, tôi đã “gặp” một protein mạnh mẽ được gọi là Nhân tố Chuyển đổi Tăng trưởng-beta (TGF-beta). Phân tử này là một chất kiềm chế mạnh mẽ sự tăng trưởng của tế bào. Trong cơ thể của chúng ta, có một số lượng lớn các protein TGF-beta như thế, tất cả chúng đều rất mạnh mẽ, trong đó, mỗi phân tử phụ trách việc hình thành và duy trì các cơ quan nội tạng chính khác nhau trong cơ thể của chúng ta. Hầu hết các protein này là chất ức chế mạnh mẽ sự tăng trưởng của tế bào. Trong cơ thể của chúng ta, cũng có một nhóm lớn các protein có chức năng thúc đẩy tích cực sự tăng trưởng của tế bào. Theo trí huệ cổ xưa của Trung Quốc, thuyết cân bằng Âm và Dương ở tầm vĩ mô cũng được triển hiện hoàn hảo ở mức độ phân tử, trong thế giới vi quan của tế bào. Nghiên cứu được tiến hành trong 20 năm qua đã làm sáng tỏ chi tiết các mạng phân tử trong một tế bào bình thường, nó sẽ trải qua một vòng đời ổn định gồm có tăng trưởng, chuyên môn hóa (chúng tôi gọi là sự phân hóa), lão hóa và chết. Tại mỗi giai đoạn trong vòng đời của một tế bào, chúng ta có thể “nghe thấy giai điệu” và “nhìn thấy nhịp điệu” của sự tương tác hòa hợp tuyệt vời giữa các yếu tố Âm và Dương. Sự rối loạn cân bằng giữa hai yếu tố này được nhìn nhận là nguyên nhân chính dẫn đến hành vi ngoài tầm kiểm soát của tế bào, một trong số những biểu hiện đó chính là bệnh ung thư. Làm thế nào một tế bào bình thường chuyển thành ung thư? Điều gì đã xảy ra? Một tế bào bình thường tương tác với các yếu tố môi trường để xác định thời điểm nó có thể bước vào giai đoạn tăng trưởng, gọi là chu kỳ tế bào, trong đó bao gồm nhiều giai đoạn khác nhau, được đặt tên G1, S, G2 và M. Giữa mỗi giai đoạn có một cánh cửa. Các tế bào phải đáp ứng được một số yêu cầu trước khi nó có thể phát triển tiếp. Những cánh cửa này rất quan trọng, vì nếu một tế bào có gì đó bất ổn, những cánh cửa sẽ khởi tác dụng bảo vệ tế bào ấy bằng cách chặn nó lại ở giai đoạn đó cho đến khi vấn đề được khắc phục bằng cách nào đó. Nếu vấn đề không thể được khắc phục, tế bào sẽ kích hoạt hệ thống báo động, dẫn đến một chế độ tự hủy được sắp đặt hoàn hảo đến mức đáng kinh ngạc. Như vậy, một tế bào bình thường hoạt động phù hợp với hệ thống mà nó thuộc về. Khi có lỗi xảy ra, các tế bào có một cơ chế “hy sinh” bản thân vì lợi ích của chỉnh thể. Ngược lại, một tế bào ung thư bằng cách nào đó đã “lách” qua các luật tại mỗi cổng kiểm tra giữa các giai đoạn phát triển, qua đó tiếp tục tăng trưởng số lượng. Cơ chế tự hy sinh cũng bị loại bỏ để chúng đạt được sự “bất tử”. Tất nhiên, sự bất tử tạm thời như vậy kéo theo cái chết của cả chỉnh thể, thú vị thay, điều này phản ánh một “sinh mệnh” rất thiếu hiểu biết mà lại vô cùng ích kỷ.
Trong 20 năm qua, các nhà nghiên cứu ung thư đã biết được rằng phải mất nhiều giai đoạn để một tế bào tích lũy những lỗi protein khác nhau rồi cuối cùng quét sạch tất cả các cơ chế bảo vệ quan trọng ở cấp độ tế bào. Sau đó, tế bào ấy bắt đầu di căn, trong quá trình đó nó lại tiếp tục vi phạm nhiều luật lệ của hệ thống, bao gồm cả các luật của hệ thống miễn dịch. Giống như cảnh sát, thông thường hệ thống miễn dịch sẽ liên tục tra hỏi các hệ thống trong cơ thể để loại bỏ các tế bào bất thường.
Bí ẩn thực sự là tại sao các tế bào có thể xoay sở để tích tụ nhiều lỗi đến thế mà không bị loại bỏ. Ở mức vi quan của một tế bào, chúng tôi biết rằng có nhiều cơ chế bảo vệ được đặt ra. Trong phạm vi “trung quan” của một cơ thể, chúng ta biết rằng cũng có nhiều cơ chế bảo vệ tại chỗ. Làm sao từng cơ chế bảo vệ trong cơ thể bệnh nhân ung thư đều thất bại hết? Một số nhà sinh vật học tin rằng ung thư là do một số lỗi ở cấp độ gen, khiến cho các vật chất di truyền không ổn định, được gọi là sự bất ổn định về di truyền, dẫn đến sai lệch trên diện rộng ở cấp độ gen. Tuy nhiên, một tế bào bình thường biết cách sửa chữa một lỗi ở mức độ gen và cũng biết kích hoạt chế độ tự hủy khi nó không khắc phục nổi vấn đề.
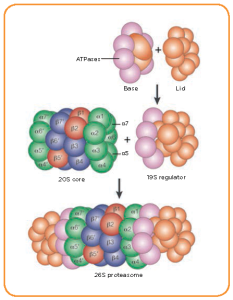
Nhiều phòng thí nghiệm, bao gồm cả của tôi, đã nghiên cứu về cách thức các tế bào giao tiếp với nhau thông qua các protein (http://www.vmresearch.org; “Nghiên cứu trong phòng thí nghiệm”). TGF-beta được tạo ra bởi hầu hết các tế bào trong cơ thể của chúng ta. Khi nó được tiết ra bên ngoài một tế bào, TGF-beta hoạt động như một tín hiệu “công bố” với những tế bào nào ở lân cận mà có một bộ các protein duy nhất dùng để nhận biết và liên kết với nó. Một khi các protein có chức năng liên kết này, còn gọi là “thụ thể”, nằm trên bề mặt tế bào, liên kết với TGF-beta, chúng sau đó sẽ “nói chuyện” với các protein bên trong tế bào. Chi tiết về các bước giao tiếp giữa các protein bên trong và các protein bên ngoài tế bào đã được nhiều phòng thí nghiệm trong cộng đồng nghiên cứu truyền tín hiệu vẽ ra một cách cẩn thận. Sau sáu năm nghiên cứu chuyên sâu và tốn kém, chúng tôi hiện đã xác định được một cơ chế chức năng thú vị của TGF-beta. Ai trong lĩnh vực này cũng đều biết rằng có một nhóm các protein bên trong tế bào tên là “Smad” đóng vai trò then chốt để thực hiện các chỉ lệnh của TGF-beta nhằm ức chế sự tăng trưởng của tế bào. Trên thực tế, nhiều bệnh ung thư, như ung thư ruột kết, ung thư tuyến tụy, ung thư vùng đầu và cổ, tất cả đều liên quan đến dị tật ở những protein Smad. Phải đến gần đây chúng tôi mới phát hiện rằng Smad thực hiện sứ mệnh của mình bằng cách trực tiếp “nói chuyện” với một hệ thống protein rất quan trọng ở bên trong tế bào. Hệ thống protein này bao gồm một lượng lớn các protein cùng nhau làm các công việc sau: 1) đánh dấu các protein già, lão hóa, hoặc protein rối loạn chức năng để tiêu huỷ; và 2) hỗ trợ hầu hết mọi chức năng của tế bào thông qua việc lần lượt loại bỏ các protein để điều chỉnh mức độ của từng loại protein đóng vai trò điều tiết trong tế bào. Hệ thống này cũng rất trọng yếu đối với hệ thống miễn dịch để tìm ra vấn đề khi virus và vi khuẩn xâm nhập cơ thể, hoặc khi một tế bào hành xử bất thường. Hệ thống protein này được gọi là “hệ proteasome”. Các sự cố của hệ thống này cũng gây cản trở chức năng kiềm chế tăng trưởng tế bào của TGF-beta.
Khi tôi đang suy tư về ý nghĩa của phát hiện này, thì một hôm, người bạn của tôi, Tiến sĩ Lili Feng gọi cho tôi. Lili là một giáo sư tại Đại học Y dược Baylor. Cả Lili và tôi đều đang tu luyện Pháp Luân Đại Pháp, một môn tu luyện cả tâm lẫn thân cổ xưa, được biết đến một cách rộng rãi phần lớn là do cuộc đàn áp Pháp Luân Đại Pháp gần đây ở Trung Quốc . Tôi biết Lili đang tiến hành một dự án khảo sát sự ảnh hưởng của tập luyện Pháp Luân Đại Pháp lên các tế bào của hệ thống miễn dịch. Lili nói với tôi rằng cô ấy đã hoàn thành nghiên cứu của mình trong việc so sánh mức độ 12.000 gen ở các học viên Pháp Luân Đại Pháp và những người không tu tập. Trước sự ngạc nhiên lớn của tôi, cô đề cập đến một số gen trong hệ proteasome. Vì vậy, tôi nhờ cô ấy gửi cho tôi những dữ liệu gốc và quyết định tìm hiểu kỹ càng hơn. Từ thời điểm đó, một luồng thông tin khai sáng tuyệt vời đã chảy vào hệ thống nghiên cứu của tôi. Các dữ liệu Lili gửi đến cho tôi là một loạt các con số được thu thập ngẫu nhiên từ các cuộc thí nghiệm. Nhưng từ đống số liệu đó, một hình ảnh hiện ra rõ nét: hơn 10 loại protein khác nhau trong hệ proteasome bị giảm mạnh trong các tế bào miễn dịch của học viên Pháp Luân Đại Pháp. Điều này cho thấy hệ proteasome sẽ bị giảm kích thước. Sẽ không có nhiều ý nghĩa nếu chỉ có hệ thống này giảm kích thước, vì việc giảm hệ proteasome sẽ dẫn đến sự tích tụ rác và protein già. Nhưng cũng trong tập dữ liệu ấy, hơn 10 loại protein khác nhau thuộc về một hệ thống protein được gọi là “ribosome” cũng bị giảm mạnh. Ribosome chịu trách nhiệm tạo protein mới. Tôi đột nhiên nhận ra rằng dữ liệu này ám chỉ sự đồng loạt giảm kích thước của toàn bộ dây chuyền sản xuất protein và tiêu thụ protein.
Hình minh họa cấu trúc của một loại proteasome (Nguồn: Internet)
Lili sau đó đề cập với tôi rằng cô ấy đã đọc bài báo về mối tương quan giữa kích thước và hoạt động của hệ proteasome với tuổi thọ, trong các thí nghiệm trên chuột. Tiến sĩ Allen Taylor từ Đại học Boston cho biết, khi các nguồn cung cấp thực phẩm bị hạn chế, những con chuột sống lâu hơn và hệ proteasome của chúng sẽ giảm kích thước[1] [3]. Sau đó tôi tìm thấy một bài báo về mối tương quan giữa sự tăng cường hoạt động của hệ proteasome với nhiều bệnh khác nhau. Bài viết nói rằng họ đã tìm thấy trong các tế bào ung thư, hệ proteasome đã hoạt động ở mức cao nhất[4]. Một bài báo thứ ba mà tôi nhận từ tay Lili đã bổ sung một điểm cuối cùng vào ý tưởng đang dần lóe lên (xem bên dưới). Trong bài báo này[5], từ những nghiên cứu tỉ mỉ về các quá trình chuyển hóa protein trong tế bào, có vẻ như 1/3 các protein mới bị tiêu hủy ngay sau khi chúng được tạo ra. Do đó, các tế bào phải làm việc trong một tình trạng rất bận rộn và lãng phí.
Lili và tôi bắt đầu gửi email tới lui. Lili có một khiếu hài hước tuyệt vời và một trí tưởng tượng rất phong phú. Một ngày nọ cô ấy hỏi tôi: “Anh có biết các proteasome là gì trong thế giới vi mô không?” Sau đó cô tự trả lời luôn: “Các lỗ đen.” Rồi cô gửi cho tôi một tập báo cáo về cách thức hoạt động của lỗ đen trong vũ trụ. “Anh thấy đấy”, cô nói, “các proteasomes rất bận rộn khi các tế bào bị bệnh, và khi các lỗ đen rất bận rộn thì có nghĩa là gì?” Khi nghe điều đó, tôi nghĩ đến những hiện tượng trong lối sống hiện đại của chúng ta: sản xuất hàng loạt và tiêu thụ hàng loạt. Điều này thật đáng kinh ngạc, từ vi mô đến vĩ mô, các hệ thống vũ trụ khác nhau của tế bào, cơ thể, xã hội và toàn thể vũ trụ, thể hiện mối tương đồng và đối ứng đáng kể.
Đến lúc này, khi tôi quay trở lại với câu hỏi: “Điều gì làm cho các tế bào ung thư tích lũy quá nhiều lỗi và vi phạm nhiều cơ chế bảo vệ khác nhau như vậy?”, một câu trả lời đơn giản nhưng rõ ràng hiện lên trong tâm trí của tôi: “Đó là tốc độ siêu trao đổi chất của protein!” Nếu tất cả các tế bào trong một cơ thể đang trong trạng thái sản xuất hàng loạt, hệ proteasome sẽ có khả năng bị quá tải và không thể tiêu hủy các protein già và bị hỏng, từ đó lại gây ra những lỗi khác, phá vỡ sự cân bằng. Vì các protein là nhân vật chính trong tất cả các chức năng của tế bào, khi các protein xấu không thể bị loại bỏ, chúng sẽ tiếp tục gây tác hại đến toàn bộ hệ thống cho đến khi cả hệ thống bị mất kiểm soát. Dù các tế bào có cố gắng tăng số lượng sản xuất proteasome đến mấy, nếu sự chuyển hóa tiếp tục tăng, các tế bào cuối cùng sẽ không quản lý nổi nữa. Mức tăng proteasome được tìm thấy trong các tế bào ung thư phản ánh một trận chiến cuối cùng của các tế bào nhằm cố giành lại sự cân bằng.
Tôi không thể không tự hỏi có bao nhiêu trong số những căn bệnh mà người hiện đại đang mắc phải là hậu quả của lối sống xô bồ, sự căng thẳng tinh thần, và những mưu cầu bất tận đang cuộn lấy tâm trí và trái tim của họ. Tất cả đều có thể, thông qua hệ thống pyschoneuroendocrine độc đáo của con người, truyền đến cấp độ tế bào yêu cầu gia tăng sự trao đổi chất của tế bào, cho đến khi nó làm các hệ thống proteasome quá tải, dẫn đến sự tích tụ của những lỗi sai của tế bào, và cuối cùng dẫn đến sự sụp đổ của hệ thống cơ thể. Nói sâu hơn, phải chăng sự ham muốn bất tận đối với tiền của, vật chất, danh lợi và quyền lực cũng gắn liền với nhiều căn bệnh của xã hội?
Vậy đâu là phương thuốc cho bệnh ung thư? Đâu là phương thuốc cho tất cả các vấn đề của xã hội? Điều gì có thể làm chậm lại các hoạt động của lỗ đen trong vũ trụ? Vấn đề chữa bệnh ung thư cũng trọng đại tương đương với hai vấn đề kia. Nhưng liệu có một nguyên nhân chung cho cả ba không? Liệu có một Pháp lý vũ trụ nào mà khi vi phạm điều đó sẽ dẫn đến sự xuất hiện của tất cả các vấn đề vũ trụ, từ nhỏ đến lớn không? Có thể nào tất cả mọi thứ chúng ta nhìn thấy trong thế giới vật chất này chỉ đơn thuần là một biểu hiện của cái mà chúng ta gọi một cách mơ hồ là “ý thức” không?
Thế giới của tinh thần và ý thức: đây là vùng xám cấm đụng chạm đối với khoa học hiện đại. Khoa học hiện đại cách ly nó ở ngoài và tin rằng chúng ta chỉ có thể hiểu được tự nhiên bằng cách tách bạch hoàn toàn vật chất ra khỏi tinh thần. Nhưng bản chất của tinh thần là gì? Nó có mối liên hệ gì với vật chất? Nếu không biết câu trả lời cho những câu hỏi này, chúng ta liệu có thể thực sự an tâm và tự tin rằng mình có thể hiểu được các quy luật của cơ thể chúng ta và luật của vũ trụ ở mức độ vật chất này?
Chàng trai Narcissus trong thần thoại Hy Lạp (Nguồn: Internet)
Trước chuyến đi đến Boston, tôi đã đọc được một bài báo trên tạp chí Science, trong đó trên trang bìa là một bức tranh nổi tiếng của Michelangelo Merisi da Caravaggio (1573-1610), chàng Narcissus trong thần thoại Hy Lạp. Narcissus nhìn thấy hình ảnh phản chiếu của chính mình trên mặt nước, rồi yêu say đắm hình ảnh của chính mình. Anh không thể từ bỏ niềm đam mê với hình ảnh đó, và dồn tất cả sự quan tâm của mình vào nó, khiến cho nó rút cạn tất cả sức lực của mình, và cuối cùng chàng đã chết. Lúc đầu tôi nghĩ: “Tại sao Narcissus không nhận ra rằng đó là hình ảnh của chính mình?” Tất nhiên tôi đoán là thời đó họ chưa có gương. Nhưng sau đó tôi tự hỏi: “Tại sao anh ta không tự nhìn kỹ lại bản thân mình? Nếu làm được như thế thì anh ta đã có thể phát hiện ra có rất nhiều điểm tương đồng từ hai bàn tay đến quần áo và những thứ khác.” Sau đó, tôi mỉm cười khi nhận ra, trên thực tế có bao nhiêu người trong chúng ta tự nhìn lại chính mình trong cuộc sống của chúng ta? Khi gặp vấn đề, chúng ta hướng về tất cả mọi thứ bên ngoài, ngoại trừ chính mình. Sinh, lão, bệnh, tử, tất cả chúng ta tìm kiếm những câu trả lời từ bên ngoài. Chúng tôi đã dành rất nhiều tài nguyên để tìm ra phương pháp chữa trị cho các căn bệnh. Hiện nay chúng tôi đang hy vọng một ngày nào đó sẽ có một siêu máy tính soi sáng cho chúng ta về những bí ẩn của cuộc sống. Nhưng nếu toàn bộ thế giới vật chất này là một thế giới ảo tưởng giống như những gì mà các nhà hiền triết cổ đại đã dạy từ những thời kỳ xa xưa trước đây thì sao? Chúng ta đã thấy đủ sự đối ứng giữa vũ trụ, xã hội con người, cơ thể con người và các tế bào chưa? Liệu có phải là chúng ta đã nhìn chằm chằm vào hình ảnh của chính mình quá lâu? Liệu đã đến lúc chúng ta tìm thấy con người thật của chính mình và trở về nhà?
Diễn thuyết tại Diễn đàn Boston Future Science vào tháng 04-2002.
(Ghi chú: Sau bài phát biểu của tôi, nhiều học viên Pháp Luân Đại Pháp đã đến gặp và kể với tôi về những trải nghiệm của cá nhân họ và về cách mà họ hoặc các học viên khác đã phục hồi từ hàng loạt các bệnh “nan y” như xơ cứng toàn thân và các bệnh ung thư khác nhau thông qua tu luyện)
Tài liệu tham khảo:
1. Scrofano MM, Jahngen-Hodge J, Nowell TR Jr, Gong X, Smith DE, Perrone G, Asmundsson G, Dallal G, Gindlesky B, Mura CV, Taylor A. Ảnh hưởng của quá trình lão hóa và hạn chế calorie về mức độ dinh dưỡng trong plasma trên chuột đực và cái Emory. Mech Ageing Dev. 15 tháng 9 năm 1998; 105 (1-2): 31-44.
2. Scrofano MM, Shang F, Nowell TR Jr, Gong X, Smith DE, Kelliher M, Dunning J, Mura CV, Taylor A. Hạn chế Calorie, căng thẳng và con đường phụ thuộc ubiquitin trong gan chuột. Mech Ageing Dev. 16 tháng 11 năm 1998; 105 (3): 273-90.
3. Scrofano MM, Shang F, Nowell TR Jr, Gong X, Smith DE, Kelliher, Minnesota M, J Dunning, Mura CV, Taylor A. Lão hóa, hạn chế calo và ubiquitin phụ thuộc vào sự phân giải protein ở gan của chuột Emory. Mech Ageing Dev. 01 tháng tư năm 1998; 101 (3): 277-96.
4. Dutaud D, L Aubry, Henry L, Levieux D, Hendi KB, Kuehn L, Cục JP, và Ouali A. Phát triển và đánh giá của một chiếc bánh sandwich ELISA để định lượng các proteasome 20S trong huyết tương người. J. của miễn dịch. Meth. 2002; 260: 183-193.
5. Yewdell JW. Không như một khoa học ảm đạm: kinh tế tổng hợp protein, gấp, suy thoái và xử lý kháng nguyên. Xu hướng in Cell Bio. năm 2001; 11 (7): 294-297.
Dịch từ: http://pureinsight.org/node/195